
آنتروپی
چکیده: در این درس یکی دیگر از کمیت های ترمودینامیکی یعنی آنتروپی، معرفی شده و تاثیر آن در پیشرفت واکنش ها بررسی می شود.
شرح درس:
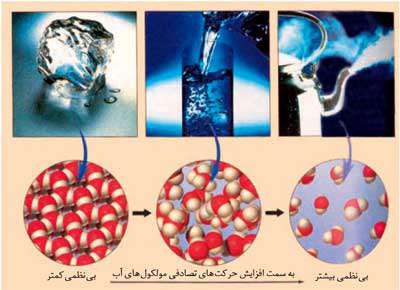
بر طبق قوانین ترمودینامیکی، مواد موجود در جهان هستی به سمت بی نظمی بیشتر تمایل دارند. در واکنش های شیمیایی نیز افزایش بی نظمی یک عامل مساعد برای پیشرفت واکنش محسوب می شود. در علم ترمودینامیک برای بیان میزان این بی نظمی کمیتی در نظر گرفته شده است که آنتروپی (S) نامیده می شود. در واقع آنتروپی را می توان معیاری از بی نظمی یک سامانه تعریف کرد.

این مفهوم در سال 1865 توسط رودولف کلازیوس دانشمند آلمانی برای توجیه جهت انجام فرایندهای فیزیکی و شیمیایی ارائه شد.کلازیوس گرمای آزاد شده یا جذب شده توسط سامانه، تقسیم بر دمای سامانه (بر حسب کلوین) را آنتروپی نامید. اما این ایده که آنتروپی به عنوان معیاری برای میزان بی نظمی در نظر گرفته شود، نخستین بار توسط لودویک بولتزمن مطرح شد.
برخلاف آنتالپی و انرژی درونی که نمی توان آنها را به طور مطلق تعیین نمود، در مورد آنتروپی می توان مقدار مطلق آن را برای هر ماده تعیین کرد. اما چگونه می توان آنتروپی مطلق مواد را اندازه گیری کرد؟
بولتزمن توانست با یک مقدار ثابت (K) بین آنتروپی(S) و تعداد آرایش های ممکن برای ذرات موجود در یک سیستم در دمای معین (ω) رابطه ای ایجاد کند؛
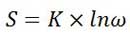
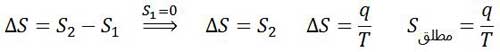
T برابر با دمای سامانه در مقیاس کلوین و q گرمای مبادله شده است.
در واکنش های شیمیایی نیز تغییر آنتروپی سامانه با داشتن مقادیر مربوط به آنتروپی مطلق مواد از رابطه زیر محاسبه می شود:
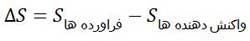
اگر ∆S مثبت باشد، یعنی در طی واکنش، سامانه نامنظم تر شده که عاملی مساعد در پیشرفت واکنش محسوب می شود و اگر ∆S منفی باشد، در آن صورت در طی واکنش، سامانه منظم تر شده و با کاهش آنتروپی همراه بوده است که این عامل مانعی برای پیشرفت واکنش می باشد.
در خصوص آنتروپی لازم است به چند نکته مهم توجه نمایید:
همانند انرژی درونی و آنتالپی، آنتروپی نیز یک تابع حالت است و تنها به حالت آغازی و پایانی هر تغییر بستگی دارد.
آنتروپی مطلق گازها از مایع ها و مایع ها از گازها بیشتر است.
هر سمتی از واکنش که تعداد مول های گازی آن بیشتر باشد، آنتروپی نیز بیشتر است.
هرچه یک مولکول پیچیده تر باشد، آنتروپی آن بیشتر خواهد بود.
مرکز یادگیری سایت تبیان- تهیه و تنظیم: مهسا شاه حسینی

















