
آنتالپی استاندارد تشکیل
چکیده: بعد از معرفی آنتالپی و شرایط استاندارد ترمودینامیکی به بررسی برخی از تغییر آنتالپی های مهم خواهیم پرداخت. در این درس آنتالپی استاندارد تشکیل معرفی می شود.
شرح درس:
آنتالپی استاندارد تشکیل یک ماده به تغییر آنتالپی واکنشی گفته می شود که طی آن یک مول ماده از عنصرهای سازنده اش در حالت استاندارد، تشکیل می شود. یکای آنتالپی استاندارد تشکیل (∆Hتشکیلo ) بر حسب kj.mol-1 گزارش می شود زیرا یک مول از ماده خاص مد نظر است.
آنتالپی استاندارد تشکیل جزو خواص شدتی سامانه است.
با توجه به اینکه گرمای استاندارد تشکیل هر ماده مرکب نسبت به عنصرهای سازنده اش ( در حالت استاندارد) سنجیده می گردد، گرمای استاندارد تشکیل عنصرها در حالت استاندارد را به عنوان مبنا، صفر در نظر می گیرند. به عنوان مثال گرمای استاندارد تشکیل (H2(g) , Br2(l), Fe(s را معادل صفر در نظر می گیریم.
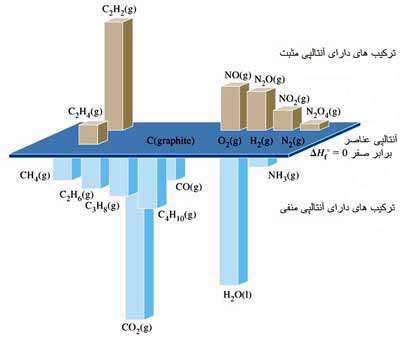
نکته: در مورد عنصرهایی که چندین "دگرشکل" دارند، آنتالپی استاندارد تشکیل پایدارترین دگرشکل در حالت استاندارد برابر صفر در نظر گرفته می شود.
در ادامه علامت مثبت یا منفی آنتالپی استاندارد تشکیل چند مورد را مشخص می کنیم و نکات ضروری را بررسی می نماییم. توجه داشته باشید که ماده مورد نظر به عنوان محصول واکنش فرض می شود و سمت چپ آن را عنصر استاندارد در نظر می گیریم و سپس گرماده یا گرماگیر بودن واکنش را تحلیل می کنیم.
الف) (Cl(g
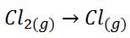
تشکیل (Cl(g با شکستن پیوند Cl-Cl همراه است پس تشکیل آن گرماگیر می باشد. ( ∆Hتشکیلo>0)
ب) C(الماس)
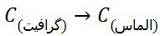
الماس نسبت به گرافیت ناپایدارتر و سطح انرژی آن بالاتر است پس تشکیل آن با مصرف گرما همراه است.
( ∆Hتشکیلo>0)
ج) Br2(g)
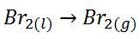
این فرایند با تبخیر (Br2(l همراه است که فرایندی گرماگیر می باشد. ( ∆Hتشکیلo>0)
د) (H2O(l
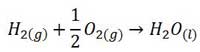
به طور کلی آنتالپی تشکیل اغلب ترکیب ها منفی است زیرا در ترکیب ها پیوند ها دارای اختلاف الکترونگاتیوی هستند لذا در آنها انرژی پیوند بیشتر، پایداری بیشتر و سطح انرژی کمتر است، پس تشکیل آنها با آزاد شدن گرما همراه می باشد.
( ∆Hتشکیلo<0)
هرچه ∆Ho یک ماده منفی تر باشد، ماده مورد نظر نسبت به عنصرهای سازنده خود سطح انرژی پایین تر و پایداری بیشتری دارد.
نکته: با توجه به جدول آنتالپی استاندارد تشکیل موجود در کتاب درسی شیمی 3، بهتر است به خاطر داشته باشید که آنتالپی استاندارد تشکیل چهار ترکیب (NO(g) , NO2(g) ,C2H2(g) ,C2H4(g عدد مثبتی است. در واقع این چهار ترکیب، نسبت به عناصر سازنده خود، از لجاظ آنتالپی، در وضعیت ناپایدارتری قرار دارند.
مرکز یادگیری سایت تبیان - تهیه و تنظیم: مهسا شاه حسینی

















