
انحلال ترکیب های یونی
چکیده:
در این درس به جزییات بیشتری پیرامون فرایند انحلال ترکیب های یونی خواهیم پرداخت و با مفاهیمی چون آنتالپی شبکه و آب پوشی آشنا خواهیم شد.
شرح درس:
به واکنش زیر توجه نمایید:
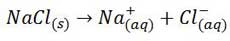
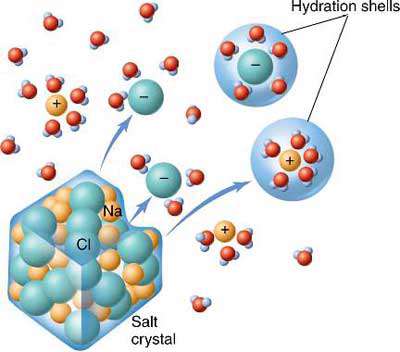
این واکنش انحلال سدیم کلرید را در آب نشان می دهد. اما این انحلال در سه مرحله صورت می گیرد:
مرحله اول- شبکه بلوری NaCl از هم فروپاشیده و یون های مجزای گازی شکل به وجود می آیند. این مرحله با صرف انرژی همراه است.
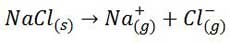
مرحله دوم- مولکول های آب از یکدیگر جدا می شوند. این مرحله نیز گرماگیر است.
مرحله سوم- یون های گازی ایحاد شده توسط مولکول های آب محاصره می شوند و جاذبه قوی بین آن ها و مولکول های آب ایجاد می شود. این مرحله گرماده است.
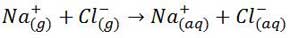
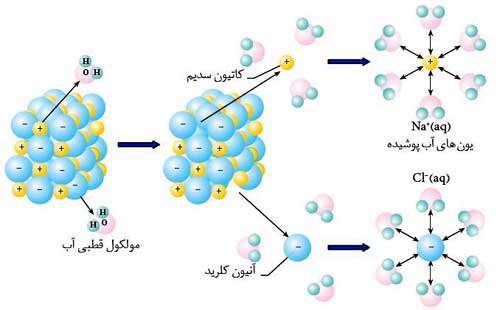
همان طور که مشاهده کردید در مرحله اول برای فروپاشی شبکه بلوری انرژی مورد نیاز است.

به مقدار انرژی لازم برای فروپاشی شبکه بلوری یک مول جامد یونی و تبدیل آن به یون های مجزای گازی شکل انرژی شبکه یا آنتالپی شبکه یا ∆Hشبکه گفته می شود.
هرچه انرژی شبکه بیشتر باشد فروپاشی شبکه بلوری سخت تر شده و احتمال حل شدن جامد یونی در آب کمتر می شود.
مجموع مراحل دوم و سوم مرحله آب پوشی نامیده می شود.

آب پوشی یا هیدراسیون عملی است که طی آن مولکول های آب از یکدیگر جدا می شوند و سپس بین مولکول های آب و یون ها جاذبه قوی برقرار می شود.
در مرحله دوم پیوندهای هیدروژنی بین مولکول های آب شکسته می شود که فرایندی گرماگیر است و در مرحله سوم جاذبه یون - دو قطبی بین مولکول های آب و یون های سدیم و کلرید ایجاد می شود که با تولید گرما همراه است. از آن حا که میزان گرماده بودن مرحله سوم از میزان گرماگیر بودن مرحله دوم بیشتر است، عمل آب پوشی همیشه گرماده می باشد.
نکته: آب پوشی یک عامل مساعد برای پیشرفت خود به خودی انحلال ترکیب های یونی محسوب می شود چون گرماده بوده و علامت ∆H آن همواره منفی است.
نکته: فرایند آب پوشی با کاهش آنتروپی (∆S) همراه است زیرا مول های گازی به صورت محلول درمی آیند و تحرک آن ها کاهش یافته و بی نظمی نیز کم می شود. اما باید توجه داشته باشید که فرایند انحلال یک جامد یونی با افزایش آنتروپی همراه است.

مرکز یادگیری سایت تبیان – تهیه و تنظیم: مهسا شاه حسینی

















